การเก็บสิ่งส่งตรวจ (SPECIMEN COLLECTION)
การเก็บสิ่งส่งตรวจเป็นขั้นตอนที่สำคัญมากขั้นตอนหนึ่งในการตรวจวิเคราะห์ทางห้องปฏิบัติการ ดังนั้นไม่ว่าจะมีเครื่องมือตรวจวิเคราะห์ดี ใช้เทคโนโลยีที่ทันสมัยหรือมีผู้ตรวจวิเคราะห์ที่มีความเชี่ยวชาญ มากเพียงใดก็ตาม ถ้าสิ่งส่งตรวจเก็บมาไม่ถูกต้องหรือไม่เหมาะสมก็จะทำให้ผลตรวจวิเคราะห์ที่ได้ผิดพลาดไม่มีความหมายเพราะไม่ได้สะท้อนถึงความผิดปกติที่เกิดขึ้นในผู้ป่วยจริงตามที่แพทย์ต้องการมากกว่านั้นหากเเพทย์นำผลตรวจวิเคราะห์ที่ได้ไปใช้ อาจทำให้ผู้ป่วยได้รับการรักษาผิดพลาดและอาจเกิดอันตรายร้ายแรงถึงแก่ชีวิตได้
ชนิดของสิ่งส่งตรวจ
สิ่งส่งตรวจที่ใช้ในการตรวจวิเคราะห์ทางห้องปฏิบัติการมีหลายชนิด อาจแบ่งได้ดังนี้
- เลือด
- ปัสสาวะ
- อุจจาระ
- น้ำไขสันหลังและน้ำเจาะจากส่วนต่างๆ ของร่างกาย
- อื่นๆ ที่นอกเหนือจากที่กล่าว เช่น เสมหะ หนอง swab ป้ายช่องคลอดเพื่อตรวจหา sperm และ acid – phosphatase เป็นต้น
เลือด (BLOOD)
ตัวอย่างเลือดที่ใช้ในการทดสอบอาจอยู่ในรูป clotted blood, serum หรือ plasma เพื่อให้ได้รูปแบบ ตัวอย่างเลือดตามที่ต้องการ และเป็นการลดความผิดพลาดในการเก็บตัวอย่างเลือด ได้มีการน าหลอดเลือดที่ มีจุกยางปิดหลอดเป็นสีต่างๆ ตามมาตรฐานสากลมาใช้ เจ้าหน้าที่เจาะเลือดต้องเลือกใช้ให้ถูกต้อง รายละเอียดเกี่ยวกับสีจุกยาง สารกันเลือดแข็งที่ใช้ และชนิดของการใช้งานในห้องปฏิบัติการดูได้ในตารางที่ 1 นอกจากนี้การเจาะเก็บเลือดในผู้ป่วยครั้งเดียวแต่มีหลายการทดสอบ (test) ที่ต้องใช้เลือดในรูปแบบต่างๆ กัน ต้องมีการจัดลำดับ (Order of draw) การใส่เลือดในหลอดเลือดที่มีจุกสีต่างๆ เพื่อลดผลกระทบจากการปนเปื้อนของสารที่เติมเข้าไปในหลอดเลือดตามลำดับก่อนหน้าติดเข็มที่เจาะมาสัมผัสกับเลือดในหลอดเลือดลำดับถัดมา (Additive carry over) ท าให้ผลตรวจวิเคราะห์ที่ได้ผิดพลาด ลำดับของการเลือกใส่เลือดในหลอดจุกสีต่างๆ ในการเจาะเลือดผู้ป่วยครั้งเดียวแต่มีหลายการทดสอบ ที่ใช้เลือดในรูปแบบต่างกัน
เทคนิคการเจาะเก็บเลือด
- การเจาะเลือดจากเส้นเลือดดำ (VENIPUNCTURE)
ข้อบ่งชี้ เป็นวิธีที่ใช้ทั่วไปต้องการเลือดปริมาณมาก
ตารางที่ 1. แสดงสีจุกหลอดเลือด, สารกันเลือดแข็งที่ใช้ และชนิดของการใช้งานในห้องปฏิบัติการ

ลำดับการใส่เลือดลงในหลอดเลือด (สีของจุก) ชนิดต่างๆ ในการเจาะผู้ป่วยทั้ง 2 ระบบแบบ
ใช้ไซริงจ์และแบบใช้หลอดระบบสูญญากาศ
ลำดับที่ 1 ขวดอาหารเพาะเชื้อสำหรับเพาะเชื้อจากเลือด (ในกรณีที่ต้องการส่งตรวจ Hemoculture)
ลำดับที่ 2 หลอดเลือดที่มี sodium citrate (จุกสีฟ้า)
ลำดับที่ 3 Clotted Blood (จุกสีแดง)
ลำดับที่ 4 หลอดเลือดที่มี heparin (จุกสีเขียว)
ลำดับที่ 5 หลอดเลือดที่มี EDTA (จุกสีม่วง)
ลำดับที่ 6 หลอดเลือดที่มี sodium fluoride (จุกสีเทา)
ตำแหน่งที่เหมาะสม
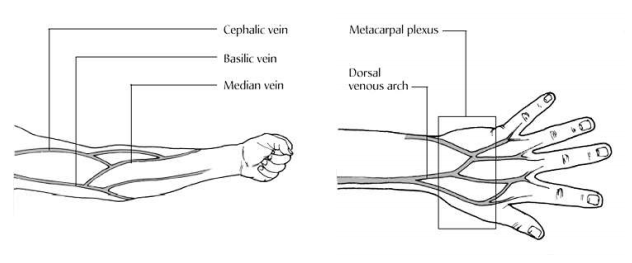
- เส้นเลือดดำบริเวณข้อพับแขน (Antecubital fossa) มี 3 เส้นหลักคือ Median cubital vein, Cephalic vein และ Basilic vein ตามรูปประกอบ ให้พิจารณาเลือกเจาะเรียงตามลำดับดังกล่าว
- เส้นเลือดดำหลังมือ มี 2 เส้น คือ Metacarpal plexus และ Dorsal venous arch
- เส้นเลือดดำหลังเท้า ถ้าไม่สามารถหาเส้นเลือดที่เหมาะสมในตำแหน่งดังกล่าว อาจเลือกเส้นเลือดดำที่ไหปลาร้า (Subclavian vein) หรือเส้นเลือดดำที่ขาหนีบ (Femoral vein) ซึ่งต้องใช้ผู้ที่มีความชำนาญ
ตำแหน่งที่ควรหลีกเลี่ยงในการเจาะเลือด
- บริเวณที่เป็นแผลเป็น เนื้อเยื่อหนาทำให้เจาะยาก
- บริเวณที่มีเส้นเลือดดำขอด (Thrombosis vein) เส้นเลือดหนาและดิ้น
- บริเวณที่มีรอยช้ำแดง หรือมีเลือดออกใต้ผิวหนัง เห็นตำแหน่งเส้นเลือดไม่ชัดทำให้เจาะยาก
- แขนข้างเดียวกับหน้าอกที่ผ่าตัด (Mastectomy) การเจาะเลือดจะทำให้ผู้ป่วยเสี่ยงต่อการติดเชื้อและปวดเจ็บนานเนื่องจากมีน้ำเหลืองคั่งภายหลังเจาะ ถ้าจำเป็นต้องเจาะต้องได้รับความ ยินยอมจากแพทย์
- แขนข้างที่ทำ AV shunt ของคนไข้ที่ใช้ในการล้างไต (dialysis) ผู้ป่วยเสี่ยงต่อการติดเชื้อ
- แขนข้างที่กำลังให้สารน้ำ (Intraveneous Fluid ) การเจาะเลือดจากแขนนี้จะทำให้เลือดที่ได้มีการปนเปื้อน ทำให้ผลวิเคราะห์ผิดพลาด เช่น ได้ค่า Glucose สูง ค่า Hematocrit ต่ำ ถ้าจำ เป็นให้เจาะเส้นเลือดนั้นตรงบริเวณที่อยู่ใต้ตำแหน่งที่ให้ โดยหยุดให้ IV ก่อน 2 นาที และควรปรึกษาแพทย์ก่อน
การเจาะเส้นเลือดดำโดยใช้ไซริงจ์ (Syringe method)
อุปกรณ์
- เข็มและไซริงจ์ขนาดตามที่ต้องการ ปกติจะใช้เบอร์ 21, 22
- สายยางรัดแขน (Touniquet)
- สำลีและแอลกอฮอล์ฆ่าเชื้อโรค
- ถุงมือ
- หลอดเก็บเลือด เลือกใช้ให้เหมาะสมกับการทดสอบ
- หมอนรองแขนเจาะเลือด
ขั้นตอนการเจาะ
- ผู้เจาะล้างมือ เช็ดให้แห้ง สวมถุงมือ และเตรียมอุปกรณ์ต่างๆ ให้พร้อม วางไว้ให้หยิบฉวยได้สะดวก
- ผู้เจาะสอบถามชื่อผู้ป่วย โดยให้ผู้ป่วยบอกชื่อ -นามสกุล (ไม่ควรที่ผู้เจาะขานชื่อผู้ป่วยเองแล้วถามว่าใช่หรือไม่) พร้อมตรวจดูชื่อและรายการที่ตรวจในใบสั่งตรวจ อาจต้องถามคนไข้ว่าอดอาหาร (Fasting) มาหรือไม่
- ให้ผู้ป่วยนั่งลงพร้อมวางแขนลงบนหมอนรองแขนในลักษณะหงายมือ พาดลงและเหยียดตรง
- ผู้เจาะใช้สายยางรัดแขนเหนือบริเวณที่เจาะ 3 – 4 นิ้ว (ผูกเป็นห่วงอย่าผูกเงื่อน ให้ปลายทั้งสองข้างสามารถถูกปลดออกได้ง่าย) บอกให้ผู้ป่วยกำมือ (ไม่ควรรัดแขนนานเกิน 1 นาที ถ้าไม่สามารถดำเนินการขั้นตอนต่อไปภายใน 1 นาที ให้คลายสายรัดออกก่อน)
- หาตำแหน่งที่จะเจาะ เลือกเส้นเลือดขนาดใหญ่และมองเห็นชัด
- ทำความสะอาดและฆ่าเชื้อโรคบริเวณที่เจาะ โดยใช้สำลีชุปแอลกอฮอล์ หมุนเป็นวงกลมเริ่มจากตรงกลางหมุนออกนอก ทิ้งให้แห้ง ห้ามแตะต้องบริเวณนั้นอีก
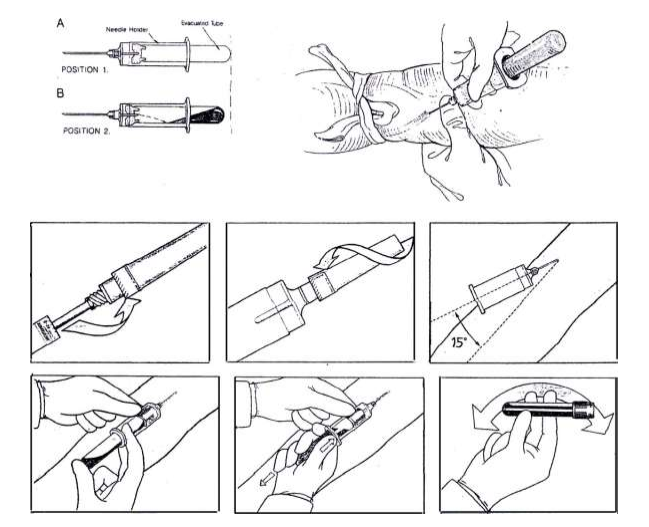
- นำเข็มติดเข้ากับไซริงจ์ให้แน่น ดึงปลอกเข็มออก เช็คลูกสูบโดยดึงลูกสูบเข้าออก 1 ครั้ง
- ใช้นิ้วหัวแม่มือ ข้างหนึ่งกดดึงผิวหนังให้ตึงตรงบริเวณต่ำกว่าจุดที่จะเจาะประมาณ 1 -2 นิ้ว มืออีกข้างหนึ่งจับไซริงจ์และเข็มที่เตรียมไว้ หงายปลายตัดของเข็มขึ้น วางเข็มและไซริงจ์ ทำมุม 15 – 30 องศากับแขนในทิศทางเดียวกับเส้นเลือด แทงเข็มผ่านผิวหนังเข้าสู่เส้นเลือด หากปลายเข็มอยู่ในตำแหน่งที่เหมาะสมเลือดจะไหลเข้าสู่ไซริงจ์ ให้รีบปลดสายยางรัดแขนออกโดยดึงลงข้างล่าง (เว้นแต่พิจารณาแล้วว่าหากปลดสายยางรัดแขนออกอาจทำให้การเจาะเลือดล้มเหลวเจาะไม่ได้เลือดตามต้องการ)
- เมื่อเลือดไหลเข้าสู่ไซริงจ์ จับไซริงจ์ให้มั่นดึงลูกสูบเข้าช้าๆ จนได้ปริมาตรเลือดตามที่ต้องการ (พยายามอย่าให้เลือดมีฟองอากาศ)
- ถอนเข็มออกจากเส้นเลือดพร้อมปิดปากแผลด้วยสำลีแห้ง ให้ผู้ป่วยใช้มืออีกข้างจับสำลีกดบาดแผล (ไม่ควรให้ผู้ป่วยพับแขนหนีบสำลีไว้ )
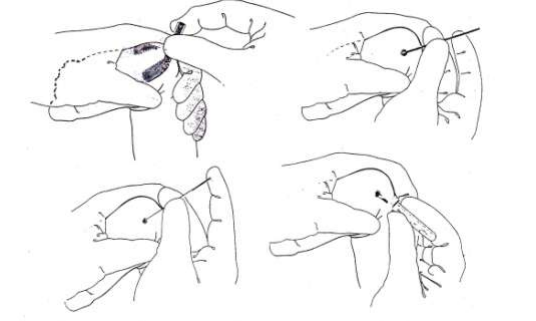
- ผู้เจาะรีบนำเลือดที่เจาะได้ใส่ในหลอดเลือดที่เตรียมให้เป็นไปตามลำดับ ดังในรูป (กรณีที่ต้องใช้หลายหลอดเก็บเลือดตามชนิดของการทดสอบ)
– ในกรณีที่ใช้หลอดเก็บเลือดเป็นหลอดสูญญากาศ ให้แทงเข็มผ่านจุกยางเข้าไป ปล่อยให้แรงดันสูญญากาศดูดเลือดเข้าไปในหลอดเลือดเอง โดยไม่ต้องดันกระบอกสูบ เมื่อเลือดหยุดไหลเข้าหลอดเลือดให้ดึงเข็มออกจากจุกยาง ทำเช่นเดียวกันในหลอดเลือด
– ในกรณีที่ใช้หลอดเก็บเลือด ที่ไม่ใช่หลอดสุญญากาศ เปิดจุกหลอด ปลดเข็มออกจากไซริงจ์ก่อนที่จะฉีดเลือดลงไปในหลอดเลือดโดยดันลูกสูบ เช่น หลอดเลือดที่มีจุกสีฟ้า ,สีเขียว, สีม่วง, สีเทา เป็นต้น หลังใส่เลือดลงในหลอดเลือดแล้ว ให้พลิกหลอดคว่ำลง 6 -8 ครั้ง เพื่อให้มั่นใจว่าเลือดไม่แข็งตัว
- หลังจากสิ้นสุดการถ่ายเลือดลงในหลอดเลือดแล้ว ให้ปลดเข็มทิ้งในภาชนะหรือกระป๋องทิ้งเข็มที่ฝามีรูล็อคเป็นที่ปลดเข็ม (ไม่ควรใช้มือใส่ปลอกเข็มคืนก่อนทิ้ง )
- เขียนชื่อ และรายละเอียดอื่น ลงบนป้ายที่ติดข้างหลอดใส่เลือดขณะที่คนไข้ยังอยู่ กรณีที่ใช้บาร์โค้ด ให้ติดบาร์โค้ดที่หลอดเลือดในขั้นตอนที่ 2
- ตรวจดูที่แขนคนไข้ ถ้าเลือดหยุดไหล ให้ปิดแผลด้วยพลาสเตอร์ (ถ้ามี) เด็กอ่อนที่มีอายุตำากว่า 2 ปีไม่ต้องปิดด้วยพลาสเตอร์ ทิ้งสำลีลงในภาชนะที่เหมาะสม จากนั้นกล่าวขอบคุณคนไข้
- ถอดถุงมือออกแล้วล้างมืออีกครั้งเมื่อสิ้นสุดการเจาะเลือด
การเจาะเส้นเลือดดำโดยใช้ระบบหลอดสูญญากาศ (Evacuated tube method) เป็นการเจาะเลือดโดยเลือดจะถูกดูดเข้าหลอดเลือดที่ใช้เก็บโดยตรง
อุปกรณ์
- เข็ม 2 ปลาย (Multisample needle)
- Holder
- หลอดเก็บเลือด (Evacuated tube) ชนิดต่างๆ
- สายยางรัดแขน (Touniquet)
- สำลี และแอลกอฮอล์ฆ่าเชื้อโรค
- หมอนรองแขนเจาะเลือด
- ถุงมือ
ขั้นตอนการเจาะ
- ดำเนินการเช่นเดียวกับการเจาะโดยใช้ไซริงจ์และเข็มในขั้นตอนก่อนเจาะ
- นำเข็ม 2 ปลายประกอบเข้ากับ Holder โดย ใช้ด้านสั้นของเข็ม (ด้านที่มีปลอกยางหุ้มเข็มและเป็นเกลียว) ใส่เข้าใน Holder หมุนตามเข็มนาฬิกาจนแน่นสนิท
- ถอดปลอกเข็มออก ดึงผิวหนังให้ตึงแล้วแทงเข็มไปในทิศทางเดียวกับเส้นเลือด โดยทำมุมประมาณ 15 องศา กับผิวหนัง
- จับ Holderให้มั่นคงใส่หลอดเลือดด้านที่มีจุกยางเข้าไปใน Holder ขณะที่มือข้างถนัดตรึงเข็มที่แทงอยู่ในเส้นเลือดไม่ให้ขยับ ส่วนมืออีกข้างเกี่ยวปีกของ Holder ด้วยนิ้วชี้และนิ้วกลาง ใช้นิ้วโป้งแตะก้นหลอดเลือดแล้วดันเข้าโดยให้เข็มที่มียางหุ้มอยู่แทงผ่านจุกยางของหลอด เลือดสูญญากาศ ถ้าเข็มอยู่ในเส้นเลือดในตำแหน่งที่เหมาะสมเลือดจะถูกดูดเข้าหลอดเลือดเองเมื่อเลือดไหลเข้าหลอดเลือดแล้วให้ปลดสายยางรัดออก
- เมื่อหลอดเลือดแรกมีเลือดไหลเข้าจนถึงปริมาณที่กำหนดและหยุดไหลให้ดึงหลอดเลือดนั้นออกจาก Holder ขณะกำลังจะเปลี่ยนหลอดเลือดต้องจับเข็มให้มั่นคงเพื่อไม่ให้เข็มหลุดออกจากเส้นเลือด จากนั้นให้ใส่หลอดเลือดถัดไปตามลำดับเช่นเดียวกับการเจาะด้วยไซริงจ์
[ คำเตือน ! ] หลังเจาะเลือดใส่หลอดที่มีสารกันเลือดแข็ง ต้องพลิกหลอดคว่ำขึ้นคว่ำลง 6 – 8 ครั้ง ก่อนจะวางหลอดไว้ หรือเก็บเลือดหลอดถัดไป
- เมื่อได้เลือดตามต้องการแล้ว ดึงเข็มออก ปิดแผลด้วยสำลีแห้ง รอเลือดหยุดไหล แล้วจึงปิดพลาสเตอร์
- ปลดเข็มออกจาก Holder โดยใช้ Reshield ที่มีปลอกเข็มวางอยู่ หรือปลดที่ฝากระป๋องทิ้งเข็มซึ่งมีตัวล็อคสำหรับปลดเข็ม (ไม่ควรใช้มือใส่ปลอกเข็มคืนก่อนทิ้ง)
2. การเจาะเลือดจากเส้นเลือดฝอยบริเวณผิวหนัง (Skin Puncture)
ข้อบ่งชี้ใช้กรณีที่ต้องการเลือดจำนวนน้อย หรือเจาะ venipuncture ไม่ได้
ตำแหน่งที่เหมาะสม
- ปลายนิ้วมือ
- ส้นเท้า
อุปกรณ์
- ถุงมือ
- Lancet หรือเครื่องมือเจาะเลือด
- สำลีชุบแอลกอฮอล์ฆ่าเชื้อ
- Microhemacrit tube หรือหลอดเก็บเลือดขนาดเล็ก
- สำลีแห้ง หรือผ้าก๊อซปลอดเชื้อ
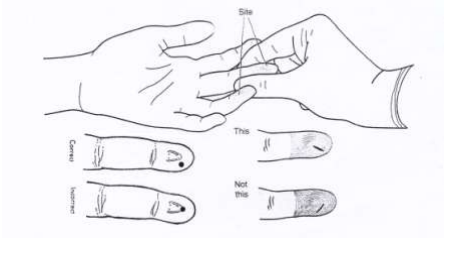
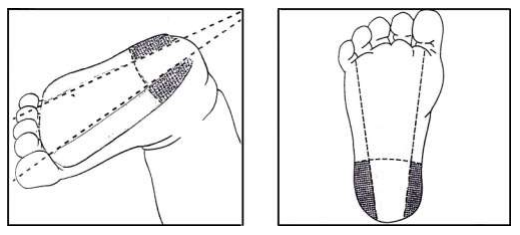
1. การเจาะปลายนิ้ว (Finger Puncture) ใช้เจาะในผู้ใหญ่และเด็กที่มีอายุมากกว่า 1 ปี นิ้วที่ใช้ (ถูก) เจาะ คือ นิ้วนางและนิ้วกลาง ซึ่งทั้งสองนิ้วนี้ก่อให้เกิดผลแทรกซ้อนน้อยกว่านิ้วอื่นๆ ตำแหน่งที่เจาะคือ จุดกึ่งกลางระหว่างตรงกลางนิ้ว (เนินนูน) กับด้านข้างของนิ้วโดยให้แผลที่เจาะตั้งฉากกับเส้นลายนิ้วมือ ดังรูป
2. การเจาะส้นเท้า (Heel Puncture) ใช้เจาะในทารกแรกเกิดและเด็กที่ยังไม่เริ่มเดิน ขณะเจาะต้องยึดข้อเท้าเด็กให้มั่นคง ทำโดยใช้นิ้วชี้ของผู้ทำการเจาะเลือดวางหรือจับตรงโค้งของฝ่าเท้า และนิ้วหัวแม่มือให้วางอยู่ห่างจากบริเวณที่เจาะ ตำแหน่งที่เจาะคือด้านข้างทั้ง 2 ของส้นเท้า ดังรูป
ขั้นตอนการเจาะ
- ขั้นตอนแรกทำเช่นเดียวกับการเจาะเส้นเลือดดำ
- ใช้สำลีชุปแอลกอฮอล์ฆ่าเชื้อเช็ดบริเวณที่เจาะ
- รอให้บริเวณที่เจาะแห้ง ใช้ lancet หรือเครื่องมือเจาะ เจาะผิวหนังบริเวณดังกล่าวในทิศทาง ที่ทำให้รอยแผลที่เกิดขึ้นตั้งฉากกับลายนิ้วมือ หรือนิ้วเท้า ลึกประมาณ 2 – 3 มม. แล้วแต่ ขนาดของผู้ป่วย ปล่อยให้เลือดไหลออกมาอิสระ [คำเตือน !] ห้ามบีบหรือเค้นบริเวณที่เจาะแรงๆ เพราะอาจทำให้เม็ดเลือดแดงแตก หรือเกิดการปนเปื้อน เนื้อเยื่อและของเหลวทำให้ผลผิดพลาด
- ใช้สำลีหรือผ้าก๊อซเช็ดเลือดหยดแรกทิ้งไปก่อน แล้วจึงเก็บหยดเลือดต่อไป
- ใช้ hematocrit tube วางไว้ใกล้หยดเลือดรองรับหยดเลือดที่ไหลออกมาในตำแหน่งเป็นมุม ฉาก ปล่อยให้เลือดไหลลงหลอด อาจต้องบีบนิ้วหรือส้นเท้าเบาๆ เพื่อให้เลือดไหลอย่าง ต่อเนื่องจนได้เลือดครบตามต้องการ ในกรณีที่ต้องใช้ตัวอย่างเลือดหลายรูปแบบให้จัดลำดับการเก็บเลือดดังนี้ 1. หลอดจุกม่วงขนาดเล็ก (EDTA tube) 2. หลอดจุกสีอื่นๆ ขนาดเล็ก (tube with additive) 3. หลอดจุกแดงขนาดเล็ก (Serum tube) สำหรับหลอดเลือดขนาดเล็กข้อ 1 และ 2 ต้องปิดฝาและเขย่าแบบคว่ำขึ้นลงอย่างน้อย 8 -10 ครั้ง ทันทีเพื่อป้องกันการเกิดลิ่มเลือดแข็งตัวเล็กๆ ทำให้ผลผิดพลาดได้
ปัสสาวะ (URINE)
ข้อบ่งชี้ มีหลายแบบขึ้นอยู่กับวัตถุประสงค์ของการตรวจแต่ละประเภท
- SINGLE SPECIMEN คือการเก็บปัสสาวะครั้งเดียว แบ่งเป็น
1.1 Random urine เก็บเมื่อใดก็ได้ ใช้เก็บปัสสาวะตรวจในงานประจำวัน เช่น U/A , น้ำตาล โปรตีน และภาวะตั้งครรภ์
วิธีเก็บ
- ให้ผู้ป่วยถ่ายปัสสาวะตอนแรกทิ้งไปก่อน (ปัสสาวะส่วนแรกทำหน้าที่ขจัดสิ่งปนเปื้อนภายใน ท่อปัสสาวะทิ้งไป)
- ใช้ภาชนะใส , สะอาด , แห้ง และปากกว้าง รองรับตอนกลางของปัสสาวะที่กำลังไหลให้ได้ ปริมาณ 30 มล.
- ปัสสาวะส่วนท้ายให้ทิ้งไป
1.2 First morning urine คือการเก็บปัสสาวะครั้งแรกหลังตื่นนอน ซึ่งปัสสาวะนี้เป็น ปัสสาวะที่อยู่ในกระเพาะปัสสาวะมาเป็นเวลาไม่น้อยกว่า 8 ชั่วโมง มีความเข้มข้นมากกว่าปัสสาวะช่วงเวลา อื่นๆ โอกาสที่จะตรวจพบความผิดปกติทางพยาธิสภาพของสิ่งต่างๆ ได้มากกว่า รวมทั้ง nitrite และ โปรตีน วิธีการเก็บและนำส่งเช่นเดียวกับข้อ 1.1 1.3 Fractional urine คือการเก็บปัสสาวะเป็นช่วงเวลาที่กำหนด เช่น การเก็บปัสสาวะใน ขณะที่ทำ Glucose Tolerance test ซึ่งจะต้องปัสสาวะทิ้งไปก่อนที่จะเริ่มให้รับประทานกลูโคส หลังจากนั้น 2 ชั่วโมงเก็บปัสสาวะอีกครั้ง (ถ้าได้) วิธีการเก็บและนำส่ง เช่นเดียวกับข้อ 1.1
2. CATHETERIZED SPECIMEN คือการเก็บปัสสาวะโดยวิธีสวนให้ปัสสาวะไหลออกมาเอง ใส่ใน ภาชนะที่เก็บ วิธีการเก็บและนำส่งเช่นเดียวกับข้อ 1.1
3. TIMED SPECIMEN คือการเก็บปัสสาวะในช่วงเวลาที่กำหนด เช่น ปัสสาวะ 24 ชั่วโมง นิยมใช้ส่ง ตรวจหาสารเคมี หรือฮอร์โมนที่ถูกขับออกมาทางปัสสาวะว่ามีปริมาณมากน้อยเท่าใด การนำส่ง ตัวอย่างปัสสาวะทุกแบบ ควรนำส่งทันที เพราะว่าส่วนประกอบของปัสสาวะเริ่มต้นสลายใน เวลา 30 นาที ที่อุณหภูมิห้อง หรือภายใน 4 ชั่วโมง เมื่อเก็บไว้ในตู้เย็น การเก็บปัสสาวะ 24 ชั่วโมง (24 hr. urine)
วิธีเก็บ
- กำหนดเวลาเริ่มต้น และเวลาสุดท้าย และวิธีเก็บให้ผู้ป่วยทราบ เช่น กำหนดให้เก็บตั้งแต่เวลา 8.00 น. ของวันที่เริ่มเก็บ เก็บจนถึงเวลา 8.00 น. ของวันถัดไป
- เวลา 8.00 น.ของวันที่เริ่มเก็บให้ถ่ายปัสสาวะครั้งแรกทิ้งไปก่อน 3. เริ่มเก็บปัสสาวะครั้ง ต่อไป และเก็บทุกครั้งที่มีการถ่ายปัสสาวะตลอดไป จนถึงเวลา 8.00 น. ของวันถัดไป
- เวลา 8.00 น. ของวันถัดไป ถ่ายปัสสาวะเป็นครั้งสุดท้าย และเก็บรวมปัสสาวะครั้งสุดท้ายนี้
- นำส่งห้องปฏิบัติการทันที
หมายเหตุ เนื่องจากต้องใช้เวลานานในการเก็บปัสสาวะอาจมีการเน่าเสียมีกลิ่น จำเป็นต้องใช้สารรักษาสภาพ และเก็บไว้ในตู้เย็น
– Toluene ใช้ปริมาณ 5-10 มล. เป็นตัวรักษาสภาพสำหรับปัสสาวะที่จะตรวจหา urea , glucose , uric acid , amino acid
– Boric acid ใช้ปริมาณ 5-10 มล. เป็นตัวรักษาสภาพสำหรับปัสสาวะที่จะตรวจหา albumin , creatinine และ ฮอร์โมนต่างๆ
อุจจาระ (STOOL OR FAECES)
อุปกรณ์
- ภาชนะปากกว้างประมาณ 50 มล. มีฝาปิดได้สนิทและเปิดได้ง่าย
- ไม้เขี่ยอุจจาระ เป็นไม้แบนๆ สะอาด
วิธีเก็บ
- ให้ผู้ป่วยถ่ายอุจจาระลงในภาชนะที่สะอาด เช่น กระโถน
- ใช้ไม้เขี่ยอุจจาระให้ได้ปริมาณเท่าปลายนิ้ว ใส่ภาชนะที่เตรียมไว้แล้วปิดฝา (ถ้าอุจจาระมีมูกเลือดปน เลือกเอาบริเวณที่มีมูกเลือด หรือส่วนที่สงสัยว่าเป็นตัวพยาธิ)
- นำส่งพร้อมใบส่งตรวจที่กรอกรายละเอียดเรียบร้อย หมายเหตุ กรณีที่ไม่สามารถนำส่งได้ทันทีให้เก็บไว้ในอุณหภูมิตู้เย็น 4องศาเซลเซียส แต่ถ้าต้องการตรวจหาเชื้อบิดมีตัว , Giardia lamblia, Balantidium coli ต้องนำส่งทันที ไม่ควรเก็บในตู้เย็น
น้ำไขสันหลัง (CEREBROSPINAL FLUID)
อุปกรณ์ ขวดสะอาดปราศจากเชื้อจำนวนอย่างน้อย 3 ขวด
ข้อบ่งชี้และวิธีเก็บ แพทย์ที่ทำการเจาะน้ำไขสันหลังจะเป็นผู้เก็บ โดยถ้ามีปริมาณมากเพียงพอ ควรแบ่งใส่ขวดที่เขียนหมายเลขไว้เป็น 1, 2 และ 3 ตามลำดับ
ขวดที่ 1 สำหรับส่งตรวจหาโปรตีน , น้ำตาลทางเคมีคลินิก (Clinical chemistry lab) และตรวจทางภูมิคุ้มกันวิทยาคลินิก (Clinical Immunology lab)
ขวดที่ 2 สำหรับส่งตรวจเพาะเชื้อทางด้านจุลชีววิทยาคลินิก (Clinical microbiology lab)
ขวดที่ 3 สำหรับส่งตรวจหา cell count , cell differential (Hematology lab)
การนำส่ง ต้องนำส่งห้องปฏิบัติการทันที
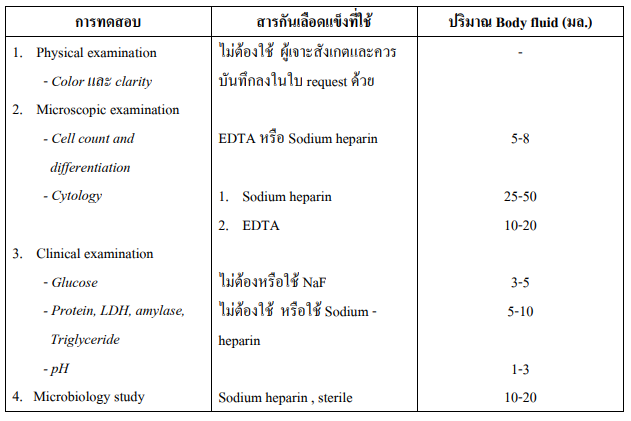
น้ำจากส่วนต่างๆ ของร่างกาย (BODY FLUID)
Body Fluid ได้แก่ Pleural fluid , Peritoneal fluid (Ascites), Pericardial fluid, Synovial fluid เป็นต้น
อุปกรณ์และข้อบ่งชี้
- ขวดหรือหลอดเลือดอย่างน้อย 3 ขวด หรือ 3 หลอด พร้อมสารกันเลือดแข็งที่เหมาะสมตาม ชนิดของการทดสอบ
- เข็มเจาะพร้อมไซริงจ์
- อุปกรณ์และน้ำยาที่ใช้ในการฆ่าเชื้อโรค
วิธีเก็บ แพทย์ผู้รักษาจะเป็นผู้เก็บโดยวิธี aseptic technique โดยใส่ body fluid ที่ได้ลงในขวดหรือหลอด เลือดเป็นไปตามชนิดของการทดสอบที่ต้องการ ดังรายละเอียดในตารางด้านล่าง การนำส่ง ให้นำส่งห้องปฏิบัติการทันที
ตาราง แสดงชนิดของการทดสอบ สารกันเลือดแข็ง และปริมาณของ Body fluid ที่ใช้